Trece científicos de la Universidad de Costa Rica (UCR) dejaron el nombre del país y el talento nacional en alto, al ayudar a responder una de las preguntas sobre cáncer más desafiantes que lleva décadas retando a la comunidad científica internacional: ¿cómo es posible que una célula cancerosa con más de 50 o 100 cromosomas logre proliferar si, en otros casos, un solo cromosoma extra puede matar una célula?
Los hallazgos científicos, cuya investigación duró nueve años y en la cual también participó una experta francesa, un alemán y un portugués/estadounidense, ya se encuentran publicados en la prestigiosa revista científica iScience.
El estudio fue liderado por el Dr. Rodrigo Mora Rodríguez, microbiólogo de la UCR, y es la primera investigación del mundo en aportar un conocimiento invaluable que resuelve parte del misterio sobre el porqué, en medio de la gran inestabilidad de los cromosomas, las células de cáncer siguen desarrollándose.
La importancia de contestar esa incógnita se debe a que una célula humana sana tiene un total de 46 cromosomas: 23 provienen del padre y 23 de la madre. Pero a veces suceden alteraciones, ya sea la pérdida de un cromosoma (monosomía) o la ganancia de uno (trisomía). En la mayoría de los casos, estas alteraciones son letales y llevan a la muerte de la célula, incluso, a nivel embrionario (durante el embarazo).
Por lo tanto, si el efecto de tener tan solo un único cromosoma de más puede ser tan letal que lleve a la muerte: ¿por qué logra desarrollarse una célula de cáncer con hasta más de 100 cromosomas?
La ciencia predice que una célula cancerosa con tanta inestabilidad cromosómica debería morir. La realidad es que algunas veces no lo hace y, en cambio, prolifera más rápido. Para la comunidad científica eso no tenía mucho sentido y ameritaba una respuesta clara.
“Por un lado, ninguna persona puede nacer si le falta un cromosoma. Por otro lado, está el hecho de que una persona pueda tener más cromosomas. Por ejemplo, poseer tres cromosomas en lugar de solo dos (trisomías). Actualmente 20, de las 23 trisomías identificadas por la ciencia, son letales. La más famosa es la trisomía 21 que, en vez de dos, hay tres cromosomas en la posición 21. Esto es lo que produce el síndrome de Down. Si bien esa no es letal, sí hay 20 cuyo desbalance de un solo cromosoma tiene efectos letales, un alto costo para las células y hasta la muerte. Entonces, ¿cómo es posible que en el cáncer tengamos no solo esos 46 cromosomas, sino hasta 50 o 100 en una misma célula y, aún así, logre proliferar?”, planteó el Dr. Rodrigo Mora Rodríguez, científico líder de la investigación.
En síntesis, lo que puede ser letal para una célula sana, no lo es para una cancerosa. En el cáncer, ese desorden en los cromosomas se traduce en una importante inestabilidad. No obstante, esta se regula a sí misma y, más bien, promueve la transformación maligna. Lo anterior influye en la aparición de la resistencia a la quimioterapia y que las células de cáncer evadan el sistema inmune.
El postulado de los científicos era que, de alguna forma, la célula de cáncer tuvo que haber desarrollado algún mecanismo para lidiar con esos efectos de la aneuploidía (desorden en los cromosomas). La tarea era encontrar cuál era ese mecanismo y los científicos costarricenses lo lograron de forma destacada para el primer gen llamado MYC.
“Este trabajo es la realización de un viejo sueño y, en palabras más científicas, de una hipótesis que Rodrigo Mora ha venido barajando, reflexionando y buscando comprobar desde la época de sus estudios de doctorado. Este es el fruto de una larga reflexión, basada en su minuciosa y perspicaz habilidad para ensamblar cosas, para intentar averiguar por qué las células cancerosas pueden enfrentarse a la aneuploidía y sobrevivir a ella cuando las células normales están muriendo a causa de ella. En ese sentido, este trabajo es un gran logro para el Dr. Mora y para el equipo costarricense, y una muy buena demostración a los jóvenes del poder de la reflexión, la paciencia y la perseverancia”, agregó la Dra. Anne Regnier, investigadora alemana.
Reportaje interactivo
Haga clic sobre la imagen para conocer cada descubrimiento de la investigación
Ajedrez Genético
Con el estudio, los y las científicas lograron proponer cuál era ese mecanismo que le permite a las células cancerosas proliferar, a pesar de tener un alto número de cromosomas.
A este mecanismo lo identificaron como compensación de dosis génica. Algo así como un ajedrez muy genético. La célula cancerosa es el rey que debe seguir en pie, aunque parte de las piezas deban omitirse o cambiarse.
Esa compensación es un prodigio del cáncer. La biología explica que si una célula sana comete un error, es normal que muera.
Por ejemplo, cuando duplica o triplica por error a otro cromosoma. A esto se le conoce como catástrofe de error y pasa muy seguido cuando se está iniciando la aneuploidía. Por eso, en la célula de cáncer también hay mucha muerte, salvo cuando se logra la combinación perfecta.
Así, durante esos eventos de aumentar o perder cromosomas, a lo interno inicia una poderosa compensación que le permite a las células cancerosas sobrevivir, no atravesar ese límite de error y entrar a una zona de crecimiento maligno. Por así decirlo, se evita la catástrofe.
Desde las palabras de la Dra. Anne Regnier, es normal que muchos errores en el proceso de replicación de las células induzcan a la muerte celular, pero las células cancerosas han desarrollado mecanismos para superar estos sistemas de protección. “Creemos que la compensación de la dosis de genes podría representar uno de esos mecanismos”, argumentó.
Hasta ahí todo está claro menos por un gran y poderoso detalle, ¿cuál es esa combinación perfecta que logra encontrar la célula de cáncer para saltarse la catástrofe del error y avanzar? En estos momentos, la célula de cáncer logró superar uno de los cuellos de botella más poderosos del cuerpo humano, de una manera completamente disruptora, rebelde y de irrespeto a las reglas.
Cuando ese cuello de botella es superado por las células cancerosas, se abren las puertas a que diferentes tipos de cáncer se generen, produzcan metástasis, sean resistentes a los fármacos y a las terapias.
“Para entender la compensación de dosis génica, primero hay que saber que la dosis génica se basa en el dogma central de la biología. El cromosoma tiene genes. El gen tiene ADN. El ADN se convierte en ARN y el ARN se convierte en proteína. Entonces, ante una cantidad de genes hay una cantidad correspondiente de ARN y de proteína. En cáncer, cuando tenés más cromosomas de la cuenta, tenés más genes y, por lo tanto, más ADN, ARN y más proteína. Esto pasa para la mayoría de los genes. Pero, existen algunos, en los cuales esto no se cumple y por lo tanto se pueden considerar compensados”, afirmó el Dr. Mora.
El problema se hace visible. Aunque hay más copias de la cuenta del gen (fragmento del ADN), a nivel de ARN o de proteína no existe esa cantidad incrementada que se esperaría tener. ¿Qué quiere decir esto? Que hay un freno en la generación de ARN que está compensando ese aumento. A esto se le llamó compensación de dosis génica.
“Si los genes de las células cancerosas no estuvieran compensados, entonces la célula de cáncer moriría. Por eso, las células de cáncer desarrollan mecanismos para mantener esa sobreexpresión bajo control. La compensación de dosis génica es un freno que evita la expresión de esos genes críticos y, por lo tanto, asegura la vida de la célula cancerosa”, ahondó el Dr. Mora.
Genes críticos
El siguiente paso de la investigación fue fundamental. Al hipotetizar que la compensación de dosis génica es lo que le permite a las células de cáncer con muchos cromosomas proliferar, lo que faltaba era identificar una cosa: ¿cuáles son esos genes críticos específicos que, si se les bloquea su mecanismo de compensación, podrían matar a la célula de cáncer?
Así se halló el gen cómplice de mayor importancia: el MYC. Este gen posee muchas copias de ADN en muchos tipos de cáncer, pero la expresión del ARN se mantiene estable. También, se encontraron otros genes, pero su importancia aún debe ser verificada.
“Investigamos esos frenos que logran la compensación de dosis génica. Primero, identificamos los genes críticos a ver cuántos hay y, segundo, estudiamos en detalle el mecanismo para bloquearlo. Si ese mecanismo se bloquea, se estaría permitiendo que el gen crítico con más copias aumente su expresión y, así, que la célula de cáncer muera”, interiorizó el Dr. Mora.
Lo anterior tiene el potencial de ser 100 % específico contra la célula de cáncer, ya que ese desorden en los cromosomas no se presenta en las células normales. Asimismo, genera una oportunidad para que, en un futuro, se desarrolle una nueva terapia basada en atacar el número de copias cromosomales alterado (aneuploidía).
“Con este conocimiento se podría aspirar a tener una terapia centrada en afrontar la aneuploidía de forma específica. Esto es completamente novedoso y de gran potencial porque no dañaría a la célula normal, pues solo la célula de cáncer tiene las copias incrementadas”, destacó el Dr. Mora.
En ese sentido, dicho mecanismo de transcripción génica (de ADN a ARN) es aún mejor que el mecanismo de nivel de proteína anteriormente descrito por otros científicos internacionales. Dirigir una terapia que detenga la compensación a nivel de proteínas es muy tóxico para las células sanas.
En cambio, el mecanismo de transcripción genética hallado por el equipo costarricense, y que por primera vez en la historia se demuestra en cáncer, brinda una oportunidad única en cuanto a innovación terapéutica.
“MYC es un oncogén, es decir, un gen con la capacidad de desencadenar y apoyar la transformación de células sanas en células cancerosas. Un sello distintivo de esta transformación es la capacidad celular para crecer sin restricciones. MYC tiene un papel esencial en esta proliferación descontrolada. Por lo tanto, parece lógico diseñar estrategias clínicas que tengan como objetivo inhibir la expresión de MYC y, por lo tanto, sus actividades para detener la progresión del cáncer", ahondó Anne Regnier.
Primeros frenos
Pero faltaba más. Ya se sabe de la compensación génica y del rol de MYC. Pero, ¿cómo es que el gen MYC logra la compensación? La respuesta fue sorpresiva: por los micro ARNs con que interactúa.
En su análisis, el equipo científico utilizó una plataforma de líneas celulares llamada CCLE. Primero, empezaron con un set de datos de 60 líneas de cáncer caracterizadas a todo nivel llamado NCI60. Posteriormente, los revisores de la revista científica iScience recomendaron analizar 1 000 líneas celulares de cáncer. El resultado en cómo se manifestaba MYC fue sorprendente.
Al identificar los genes críticos, los primeros frenos hallados por el equipo (y que inciden en la compensación genética) son los microARNs. Los microARNs son moléculas pequeñas de ARN que tienen la función de detener la transcripción génica: esa copia de ADN a ARN.
Los microARNs se unen a los ARNs mensajeros y evitan que estos luego se conviertan en proteína o, en algunos casos, hace que se degraden. Así es como las células cancerosas compensan los genes que están con copias adicionales. ¿El resultado? Que los niveles de ARN y proteínas se mantengan normales, como si fuera una célula sana.
“Cuando vemos por tipo de cáncer, la mayoría estaba compensada por MYC. Al refinar la investigación con el set de datos más grandes, nos dimos cuenta que MYC era el más importante dentro de los candidatos que teníamos”, dijo el Dr. Mora.
Imagen de microARNs hallados por el equipo científico
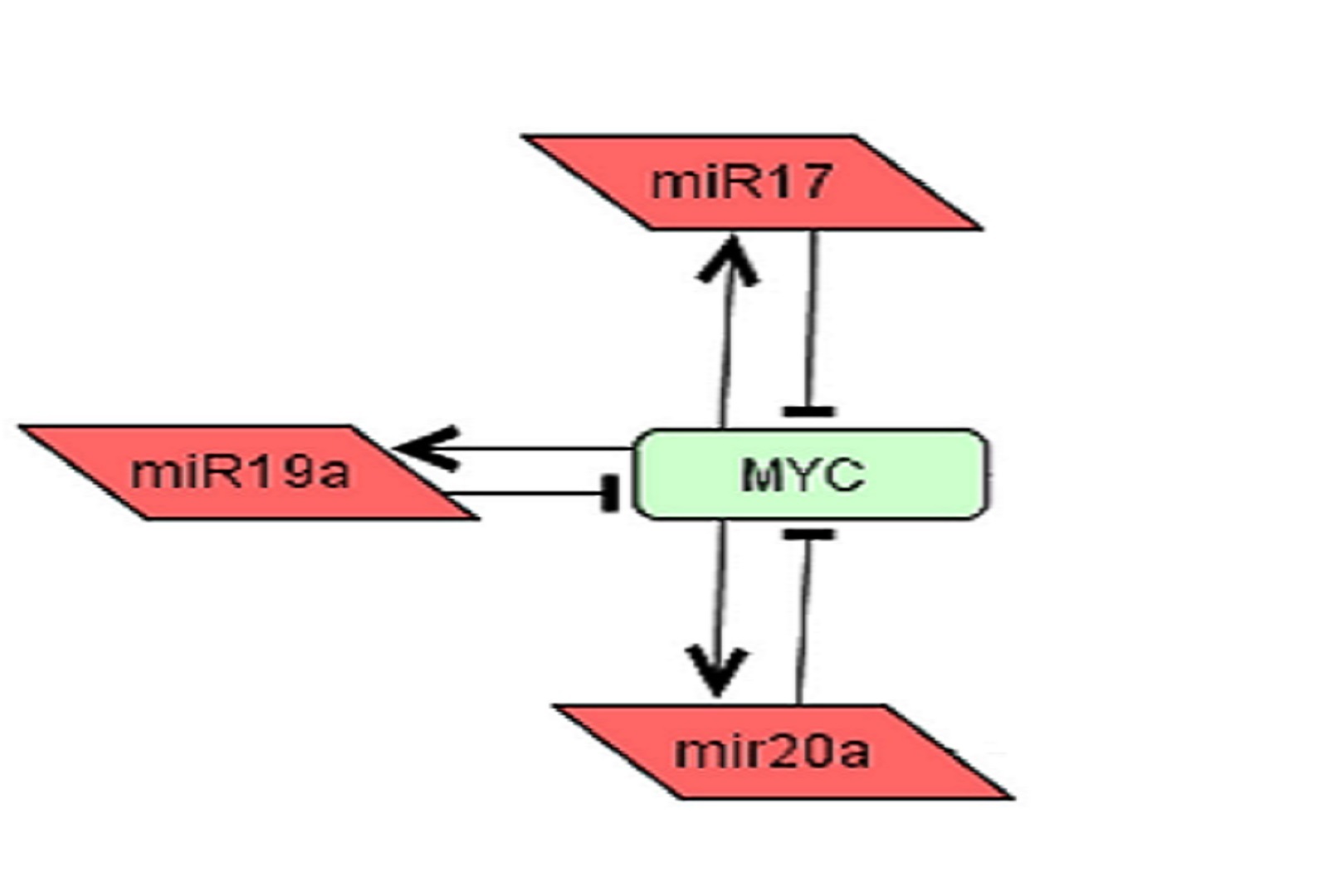
Los científicos descubrieron una tríada que se encarga de generar ese mecanismo de compensación del gen MYC. Eso es básicamente el otro producto que se tiene: un modelo mínimo de compensación de dosis génica encontrado para MYC, mediado por tres microARNs.
Viaje de algoritmos
Sin el apoyo computacional, ningún hallazgo se podría haber descubierto. Para estudiar una complejidad tan alta, en la UCR se desarrolló una plataforma bioinformática llamada BionetUCR.
Esa plataforma es la primera que se hace en el mundo para modelar, específicamente, redes de alta complejidad de microARNs y el factor de transcripción.
“Pensamos que el freno eran los microARNs, pero resulta que estos microARNs también interactúan con otros genes de proteínas muy importantes denominadas factor de transcripción. Su función es modificar la expresión de los genes mediante redes, cuando el factor de transcripción y los microARNs se unen. De hecho, son aproximadamente 3 000 microARNs que hay en las células y cada uno de ellos puede interactuar con muchos genes. El 60 % del genoma humano está controlado por microARNs, entonces, se forman redes supercomplejas que solo podían analizarse en la plataforma BionetUCR”, expresó el Dr. Mora.
Con la ayuda de la plataforma, se construyó una red y un modelo matemático robusto. Este duró cerca de tres meses corriendo en la computadora para tener el resultado final. Su objetivo consistió en simular un experimento que, de otra forma, jamás podría ser realizado en un laboratorio.
“Un elemento importante es la facilidad con que se puede realizar experimentos in silico (simulaciones) a partir de los modelos generados. Mediante modificaciones sencillas al modelo se puede simular diferentes condiciones experimentales como aumentar el número de copias de genes, inhibir factores de transcripción o microArns, etc. Cabe agregar que el tiempo requerido para una serie de experimentos sobre un modelo requería horas o algunos pocos días. Por el contrario, experimentos en laboratorio puede requerir semanas o meses para completarlos”, comentó Man Sai Acón, experto en Bioinformática de la UCR.
Las y los científicos aumentaron computacionalmente el número de copias de MYC para realizar ciertos experimentos y lograron lo insólito: definir el modelo mínimo de compensación de dosis génica al identificar cuáles miRNAs participan.
“Para MYC los frenos son tres microARNs: miR17, miR19a y miR20a. Estos forman una red. MYC estimula el micro ARN y el microARN inhibe a MYC. Los tres, cada uno por aparte y de forma redundante. Así, MYC no se sobreexpresa”, detalló el Dr. Mora.
A nivel experimental (en laboratorio), no existía forma para poder demostrar lo anterior debido a esa redundancia. Eso solo se podía definir en la computadora. Además, no existía una técnica para demostrar el circuito a nivel transcripcional (de ARN). El talento costarricense se las volvió a ingeniar y crearon la técnica “Tug-of-War” (Tira y afloja) para la identificación de compensación de dosis génica.
“Lo que hicimos fue incorporar una secuencia diferente de MYC, desde afuera de las células para diferenciarlo del MYC dentro de la célula. El MYC ubicado afuera de la célula es capaz de estimular los microARNs y, al existir el circuito de compensación, disminuye al MYC interno (endógeno). Esto demostró que ese circuito sí es capaz de ejercer compensación. Eso fue un boom y tardamos años en hacerlo. De hecho, solicitamos ayuda a nuestros colaboradores en Alemania ya que se dificultó mucho en nuestro laboratorio con las condiciones actuales”, puntualizó el Dr. Mora.
Pruebas en cáncer
Un trabajo de nueve años no concluía solo con las pruebas de rigor. Los científicos dieron la milla extra y realizaron un experimento con un modelo de cáncer de colon para conocer qué pasaba al introducir las moléculas que debilitan la compensación de MYC. El resultado respaldó los hallazgos de casi una década de estudio.
Bloquear la compensación de MYC (eliminar el freno) permite inhibir a las células de cáncer con más copias génicas. Esto sugiere que el bloquear la compensación dosis génica podría ser una estrategia nueva e interesante para eliminar el cáncer de una forma muy específica.
Por último, hicieron otro análisis para cáncer de mama, con más de 1 000 casos. Ahí se logró ajustar el modelo y separar los pacientes de acuerdo a la presencia o ausencia de compensación del gen MYC.
“Lo que vimos es que las pacientes con cáncer de mama, quienes poseen una alta compensación de MYC, tienen una menor sobrevida que los demás. Eso significa que la compensación de MYC (el hecho de que MYC esté frenado) le permite al cáncer evolucionar más, volverse más maligno y seguir avanzando”, manifestó el Dr. Mora.
A pesar de que fueron dos tipos de cáncer, las y los científicos consideran el estudio como un insumo clave para todos los tipos de cáncer y así lo vieron para todo el CCLE que incluye más de 10 tipos.
El motivo radica en que el 90 % de los tumores sólidos y el 75 % de los cánceres hematológicos tienen aneuploidía. Asimismo, muchos registran un aumento en el número de copias de MYC.
“Deseamos seguir explorando porque estamos a penas descubriendo la punta del iceberg. No solo queremos quedarnos con el MYC, sino ver la compensación en el resto del genoma. Tenemos un proyecto para generar un mapa de compensación de dosis génica a nivel de todo el genoma y a eso vamos”, concluyó el Dr. Mora.
Debido al notable hallazgo científico, el Dr. Mora fué invitado por la organización del XXIII Congreso Nacional de Ingeniería Bioquímica y a las XIX Jornadas Científicas de Biomedicina y Biotecnología Molecular en México, a presentar estos resultados en una conferencia magistral para inaugurar el tercer día de este Congreso.

Periodista, Oficina de Divulgación e Información
Área de cobertura: ciencias de la salud
jenniffer.jiwhwumenezcordoba @ucryfph.ac.cr
Comentarios:
Artículos Similares:
-
 Tico gana una de las becas más prestigiosas de Francia para especializarse en nanomedicina
Tico gana una de las becas más prestigiosas de Francia para especializarse en nanomedicina -
 Microbióloga costarricense gana uno de los premios científicos más selectos del continente
Microbióloga costarricense gana uno de los premios científicos más selectos del continente -
 Asombro, emoción y nuevos descubrimientos a 3 000 metros de profundidad en el Pacífico costarricense
Asombro, emoción y nuevos descubrimientos a 3 000 metros de profundidad en el Pacífico costarricense -
 Estudiantes de Farmacia diseñan un dispositivo, 100 % tico, para evitar intoxicaciones en niños
Estudiantes de Farmacia diseñan un dispositivo, 100 % tico, para evitar intoxicaciones en niños





